1. Números Quânticos
Schrödinger propôs que cada elétron em um átomo tem um conjunto de quatro números quânticos que determinam sua energia e o formato da sua nuvem eletrônica, dos quais discutiremos dois:
A. Número Quântico Principal (n)
O número quântico principal está associado à energia de um elétron e indica em qual nível de energia está o elétron. Quando n aumenta, a energia do elétron aumenta e, na média, ele se afasta do núcleo. O número quântico principal (n) assume valores inteiros, começando por 1.
B. Número Quântico Secundário (
Cada nível energético é constituído de um ou mais subníveis, os quais são representados pelo número quântico secundário, que está associado ao formato geral da nuvem eletrônica.
Como os números quânticos n e  estão relacionados, os valores do número quântico
estão relacionados, os valores do número quântico  serão números inteiros começando por 0 (zero) e indo até um máximo de (n – 1).
serão números inteiros começando por 0 (zero) e indo até um máximo de (n – 1).
Para os átomos conhecidos, teremos:
O número máximo de elétrons em cada subnível é:
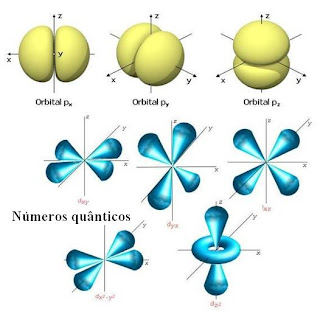
C. Número Quântico magnético (m)
Identifica o orbital em que o elétron se encontra, uma vez que cada subnível é composto por vários orbitais (apenas o subnível s possui apenas 1 orbital).
Seus valores variam de – a +
a + , inclusive zero. Veja:
, inclusive zero. Veja:
Subsível s: 0
Subsível p: -1 0 1
Subsível d: -2 -1 0 1 2
Subsível f: -3 -2 -1 0 1 2
D. Nùmero Quântico spin (s)
Indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2, indicando a probabilidade do 50% do elétron estar girando em um sentido ou no outro.
Elisa 1° 16
Nenhum comentário:
Postar um comentário